



Todos los videos





1. EL ÁTOMO A TRAVÉS DEL TIEMPO
Los griegos fueron quienes por primera vez se preocuparon por indagar sobre la materia, aunque desde una perspectiva puramente teórica, pues no creían en la importancia de la experimentación. Cerca del año 450 a. de C., Leucipo y Demócrito propusieron que la materia estaba constituida por pequeñas partículas a las que llamaron átomos, palabra que significaba indivisible.
1.1 Teoría atómica de DALTON
En 1805 el inglés John Dalton (1766-1844), rescató las ideas propuestas por Demócrito y Leucipo dos mil años atrás. La razón que impulsó a Dalton a proponer una nueva teoría atómica fue la búsqueda de una explicación a las leyes químicas que se habían deducido empíricamente hasta el momento, como la ley de la conservación de la masa y la ley de las proporciones definidas.
La teoría atómica de Dalton comprendía los siguientes postulados:
1.2 Modelo atómico de THOMSON
El descubrimiento del electrón fue posible gracias a una serie de experimentos alrededor de un dispositivo llamado tubo de rayos catódicos, que consiste en un tubo de vidrio provisto de dos electrodos, herméticamente soldados en los extremos de este y a través de los cuales se hace pasar una corriente eléctrica. En 1879, el físico inglés William Crookes, observó que si se creaba vacío dentro del tubo, retirando el aire presente en su interior, aparecía un resplandor, originado en el electrodo negativo o cátodo y que se dirigía hacia el electrodo positivo o ánodo. Posteriormente, J. Thomson estableció, en 1895, que dichos rayos eran en realidad partículas, mucho más pequeñas que el átomo de hidrógeno y con carga negativa, que recibieron el nombre de electrones.
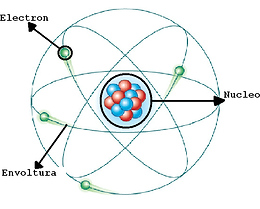
1.3 Modelo atómico de RUTHERFORD
A principios del siglo XX, Ernest Rutherford (1871-1937) realizó un experimento cuyos resultados fueron inquietantes. Observó que cuando un haz de partículas alfa, emitidas por el polonio, uno de los elementos radiactivos, golpeaba contra una lámina de oro, algunas de las partículas incidentes rebotaban, hasta el punto de invertir completamente la dirección de su trayectoria. Esto era tan increíble como si al disparar una bala contra una hoja de papel, ésta rebotara.
con el fin de dar una explicación a este hecho, Rutherford propuso, en 1911, la existencia del núcleo atómico, como una zona central densa, en la cual se concentraba cerca del 99,95% de la masa atómica. el núcleo debía ser positivo, puesto que las partículas alfa, también positivas, eran rechazadas al chocar contra los núcleos de los átomos del metal.



Para ampliar información de los Modelos atómicos
 |  |  |  |
|---|---|---|---|
 |  |  |  |



